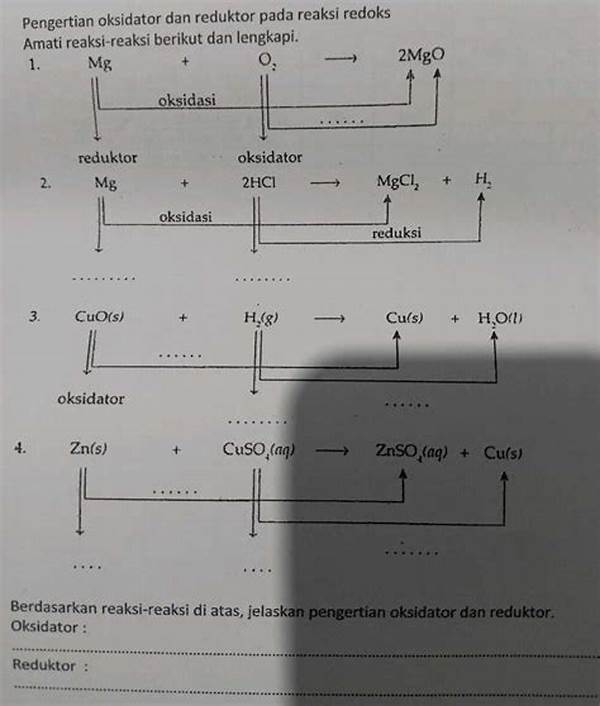
Oksidator adalah zat yang menerima elektron dari zat lain dalam reaksi kimia, sehingga zat tersebut mengalami reduksi. Dengan kata lain, oksidator menyebabkan zat lain teroksidasi.
Ciri-ciri Oksidator:
-
Menerima elektron: Dalam reaksi redoks, oksidator selalu mengalami penurunan bilangan oksidasi.
-
Menyebabkan oksidasi pada zat lain: Zat lain kehilangan elektron.
-
Dapat berupa unsur, ion, atau senyawa: Contohnya gas oksigen (O₂), ion permanganat (MnO₄⁻), atau klorin (Cl₂).
Contoh Oksidator:
-
Oksigen (O₂):
2H2+O2→2H2O2H_2 + O_2 \rightarrow 2H_2O2H2+O2→2H2O
(O₂ menerima elektron dari H₂, sehingga H₂ teroksidasi menjadi H₂O)
-
Kalium permanganat (KMnO₄): Digunakan dalam reaksi oksidasi di laboratorium.
-
Klorin (Cl₂): Digunakan untuk memutihkan atau membunuh bakteri karena bersifat oksidator kuat.
Fungsi Oksidator:
-
Mempercepat atau memicu reaksi kimia.
-
Digunakan dalam industri (misal proses pemurnian logam, desinfeksi air).
-
Penting dalam proses biologis, seperti respirasi sel.
Singkatnya, oksidator adalah zat yang menerima elektron, mengalami reduksi, dan menyebabkan zat lain teroksidasi.
Kalau mau, aku bisa buat diagram reaksi oksidator-reduktor sederhana agar lebih mudah dipahami visual.