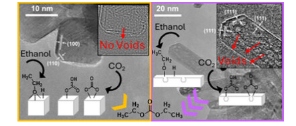
Abstrak Grafis
Katalis berbasis ceria murni dan yang didoping Zr dengan morfologi yang berbeda dikembangkan untuk sintesis langsung dietil karbonat dari etanol dan CO 2 . CeO 2 murni berbentuk batang mengungguli sampel lainnya, berkat cacat struktural yang melimpah dan kebasaan yang tinggi. Analisis FTIR in situ mengungkapkan jalur aktivasi etanol yang berbeda tergantung pada morfologi dengan pembentukan intermediet etoksi yang lebih reaktif pada permukaan yang banyak rongganya.
Abstrak
Konversi CO 2 langsung ke karbonat organik seperti dietil karbonat (DEC) menawarkan alternatif yang lebih aman untuk rute berbahaya konvensional yang melibatkan reagen beracun. Namun, stabilitas termodinamika reaktan menimbulkan tantangan bagi efisiensi. Dalam pekerjaan ini, katalis berbasis ceria berukuran nano dengan morfologi yang bervariasi disintesis melalui metode presipitasi dan hidrotermal dan diuji untuk menyelidiki mekanisme sintesis DEC dari etanol dan CO 2 . Spektroskopi inframerah transformasi Fourier (FTIR) in situ mengungkapkan bahwa CO 2 sebagian besar diserap dalam bentuk bikarbonat dan karbonat bidentat, sedangkan etoksi berdiri tipe I adalah spesies etoksi yang paling reaktif. Selain itu, sinyal yang terkait dengan pembentukan perantara monoetil karbonat juga diidentifikasi dalam spektrum IR yang dikumpulkan selama paparan ceria jenuh etanol ke CO 2 . Analisis TEM resolusi tinggi mengungkapkan bahwa morfologi berbentuk batang menunjukkan kelimpahan cacat permukaan yang lebih besar, seperti nanovoid dan langkah permukaan, dibandingkan dengan yang berbentuk kubus dan nanopartikel, yang bertanggung jawab atas aktivitas tertinggi katalis ceria batang. Katalis berbentuk batang mempertahankan kinerja tinggi selama empat siklus regenerasi dan penggunaan ulang berurutan, yang menunjukkan stabilitas dan penggunaan ulangnya. Temuan ini memberikan wawasan utama tentang hubungan struktur-aktivitas katalis berbasis ceria, yang menawarkan jalur yang menjanjikan untuk meningkatkan sintesis DEC dari CO₂.
1 Pendahuluan
Meningkatnya jumlah CO 2 di atmosfer menghasilkan kekhawatiran global karena kontribusi besar emisi CO 2 terhadap efek rumah kaca. Pada saat yang sama, CO 2 dapat dianggap sebagai sumber karbon yang murah, melimpah, dan terbarukan. Oleh karena itu, banyak perhatian telah diberikan pada pengembangan teknologi baru untuk penangkapan dan pemanfaatan CO 2 [ 1 , 2 ] Berbagai jalur pemanfaatan CO 2 telah dipelajari, yang dapat diringkas menjadi rute konversi CO 2 reduktif dan nonreduktif. [ 3 ] Jalur pertama membutuhkan masukan energi tinggi dan mencakup konversi CO 2 menjadi karbon monoksida (CO), metana, asam format, formaldehida, metanol, dan hidrokarbon, sedangkan rute kedua melibatkan konversi menjadi urea, karbamat, dan karbonat organik. [ 1 , 2 , 4 – 12 ] Meskipun hanya sebagian kecil dari total CO 2 yang dipancarkan dapat digunakan dengan cara ini, sekuestrasi CO 2 dalam karbonat organik sangat menarik bagi komunitas ilmiah karena melibatkan penggabungan CO 2 jangka panjang ke dalam senyawa yang berguna. Memang, karbonat organik mendapatkan perhatian luas karena sifat-sifatnya yang menjanjikan, termasuk toksisitas yang sangat rendah, kemampuan pelarutan yang kuat, dan biodegradabilitas yang baik. [ 13 ] Karbonat organik linier yang paling banyak diteliti adalah dimetil karbonat (DMC); namun, dietil karbonat (DEC), homolog kedua dari keluarga karbonat linier juga sangat menarik karena berbagai macam aplikasinya. [ 14 ] Ini digunakan sebagai elektrolit untuk baterai lithium-ion dan dalam produksi polikarbonat, kelas polimer yang menarik dan sukses secara komersial. [ 15 , 16 ] Ini adalah pelarut hijau yang sangat baik dan dapat digunakan sebagai reagen karbonilasi dan agen alkilasi sebagai pengganti senyawa berbahaya seperti fosgen atau alkil halida. [ 14 ] Karena kandungan oksigennya yang lebih tinggi (40,6 wt.%), DEC juga telah diusulkan sebagai pengganti metil tert-butil eter (MTBE) sebagai aditif bahan bakar yang mengandung oksigen. [ 17 ] Keuntungan lebih lanjut dari DEC dibandingkan MTBE, yang telah diidentifikasi sebagai kontaminan air tanah yang umum dan persisten adalah bahwa ia dapat terurai secara hayati dan terurai menjadi CO 2 dan etanol.
Dengan demikian, upaya telah dilakukan untuk mengembangkan jalur sintetis baru dalam konteks kemajuan berkelanjutan. Misalnya, alkoholisis urea [ 18 ] dan konversi langsung alkohol dan CO 2 . Di antara mereka, rute terakhir adalah yang paling menarik dari sudut pandang lingkungan berkat penggunaan langsung gas rumah kaca ( yaitu , CO 2 ) sebagai bahan baku dan toksisitas rendah dari reagen. Selain itu, metode ini hanya memerlukan satu langkah reaksi dan menghasilkan air sebagai satu-satunya produk sampingan (reaksi 1). Lebih jauh lagi, terutama untuk sintesis DEC, etanol dapat diperoleh dari biomassa dalam proses biorefineri dengan fermentasi gula, pati atau bahan lignoselulosa. [ 19 ] Dengan demikian, sintesis DEC mulai dari bioetanol dan CO 2 adalah pendekatan kimia hijau yang diinginkan.
![]()
Sintesis langsung memerlukan aktivasi CO 2 , yang merupakan senyawa yang inert secara kinetik dan stabil secara termodinamika (mathematical equation= −396 kJ/mol). Oleh karena itu, eksplorasi katalis dengan situs efektif untuk aktivasi CO 2 diperlukan. Selain itu, reaksi ini menunjukkan keterbatasan kesetimbangan termodinamika sehingga menghasilkan yield yang sangat rendah [ 20 ] dan karenanya saat ini masih diselidiki pada skala laboratorium. Secara rinci, sementara rute langsung ke DMC telah diteliti secara luas dan karena itu dianggap sebagai rute model untuk sintesis karbonat linear. [ 21 – 23 ] Sintesis DEC langsung dari etanol dan CO 2 hampir tidak diselidiki sejauh pengetahuan kami. [ 17 , 24 – 26 ] Berbagai macam katalis homogen telah diuji untuk konversi langsung CO 2 , terutama untuk sintesis DMC, seperti alkoksida timah, halida logam alkali, halida alkil, basa, dan cairan ionik. [ 27 – 29 ] Meskipun mereka menunjukkan efisiensi tinggi, masalah utamanya terletak pada pemisahan dan pemulihan katalis. Sebaliknya, katalis heterogen lebih cocok karena stabilitasnya yang unggul dan pemisahan katalis dari produk lebih mudah. Sampai saat ini, oksida logam transisi adalah katalis heterogen yang paling intensif diselidiki untuk sintesis langsung dialkil karbonat. [ 30 – 35 ] Telah dilaporkan bahwa larutan padat CeO 2 , ZrO 2, dan Ce x Zr 1-x O 2 efektif untuk sintesis ini karena bifungsionalitas asam-basa dari situs aktifnya. Tomishige dkk. [ 36 ] pertama kali menyarankan bahwa aktivitas dan selektivitas oksida amfiprotik untuk produksi DMC dapat dikaitkan dengan keberadaan situs asam dan basa pada permukaan katalis. Selanjutnya, banyak penelitian telah menyelidiki dan menyoroti pentingnya situs asam dan basa dalam menentukan aktivitas katalitik. [ 24 , 37 – 39 ] Namun, ketergantungannya pada situs asam-basa belum sepenuhnya dipahami. Selain itu, sifat situs aktif dapat memainkan peran penting, karena keberadaan situs asam kuat dapat menyebabkan dehidrasi alkohol dan menghasilkan eter, produk yang tidak diinginkan. [ 40 ] Oleh karena itu, penelitian lebih lanjut masih diperlukan untuk memahami bagaimana keasaman dan kebasaan katalis harus disesuaikan untuk mendapatkan katalis yang stabil dan efisien.
Beberapa penelitian telah difokuskan pada mengungkap mekanisme reaksi sintesis langsung DMC pada bahan berbasis ceria. [ 32 , 41 , 42 ] Menurut Aresta et al., CO2 bereaksi langsung dengan gugus metoksi pada permukaan katalis, sementara Santos et al. [ 43 ] mengusulkan bahwa CO2 dan metanol keduanya diadsorpsi pada situs aktif sebelum mereka bergabung satu sama lain untuk menghasilkan DMC, yang menunjukkan bahwa metanol diaktifkan menjadi spesies metil dan metoksi pada situs asam dan basa, masing-masing. Spesies metoksi pada situs basa kemudian bereaksi dengan CO2 untuk menghasilkan monodentat metoksi karbonat (MMC). Akhirnya, MMC bereaksi dengan spesies metil yang diproduksi pada situs asam untuk menghasilkan DMC. Telah disarankan juga bahwa aktivasi metanol menjadi spesies metil pada situs asam katalis adalah langkah yang menentukan laju reaksi di antara proses-proses ini. [ 44 ] Oleh karena itu, sejumlah besar situs asam dapat mendukung sintesis langsung DMC dari metanol dan karbon dioksida. Meskipun sering diasumsikan bahwa mekanisme pembentukan DEC mirip dengan DMC dan beberapa penelitian telah mengeksplorasi mekanisme sintesis DEC melalui berbagai rute (yaitu, etanolisis urea [ 45 , 46 ] dan karbonilasi oksidatif [ 47 – 49 ] ) atau aktivasi dan konversi etanol menjadi produk berharga lainnya, [ 50 – 52 ] hanya sedikit yang secara khusus menyelidiki aktivasi etanol untuk sintesis langsung DEC dan identifikasi perantara reaksinya. [ 17 , 53 ]
Sampai saat ini, penelitian tentang sintesis DEC masih terbatas. Secara khusus, sejauh pengetahuan kami, belum ada studi IR yang dilaporkan tentang penyelidikan perilaku katalis berbasis ceria untuk sintesis langsung DEC. Mengingat bahwa rute langsung menjanjikan dan menantang, pekerjaan ini bertujuan untuk memajukan pemahaman di bidang ini dengan mengidentifikasi spesies paling aktif yang terlibat dalam reaksi dan menentukan sifat struktural utama katalis yang mendorong pembentukan dan reaktivitasnya. Dalam beberapa tahun terakhir, peran morfologi CeO2 pada aktivitas katalitik telah diselidiki. Wang et al. menemukan bahwa, jika dibandingkan dengan nanokubus CeO2 yang mengekspos sisi (100) dan nanooktahedra CeO2 yang mengekspos sisi (111), nanorod CeO2 dengan sisi dominan (110) menunjukkan aktivitas katalitik tertinggi untuk produksi langsung DMC. [ 54 ] Menurut perhitungan teoritis, hal ini disebabkan oleh penyerapan CO2 pada situs aktif kekosongan oksigen yang disukai secara energetik; Selain itu bidang permukaan (110) dari CeO 2 ditemukan lebih cocok untuk produksi kekosongan oksigen dibandingkan dengan bidang (100) dan (111). [ 55 ] Berdasarkan karakterisasi spektroskopi inframerah in situ, peningkatan aktivitas ini disebabkan oleh aktifnya perantara karbonat bidentat dari adsorpsi CO 2 pada situs kekosongan oksigen permukaan nanorod CeO 2. [ 56 ]
Seperti disebutkan di atas, reaksi ini memiliki hasil yang sangat rendah. Untuk meningkatkan hasil DEC, sintesis DEC dapat dilakukan dengan adanya tekanan CO 2 tinggi atau CO 2 superkritis . Namun, kondisi seperti itu memerlukan masukan energi yang tinggi untuk penekanan. Bagaimanapun, strategi alternatif lain diusulkan untuk meningkatkan hasil. Sistem dehidrasi nonreaktif, seperti penyerap anorganik (zeolit, saringan molekuler, magnesium oksida), sistem fase gas, atau pemisahan membran, telah diselidiki untuk menghilangkan produk air dan dengan demikian memengaruhi termodinamika proses secara menguntungkan. [ 57 ] Ini memiliki keuntungan karena tidak mengganggu aktivitas katalis dan kinetika reaksi, tetapi tidak meningkatkan hasil secara memuaskan. Selain itu, sistem dehidrasi reaktif adalah senyawa anorganik atau organik yang secara aktif bereaksi dengan air. [ 57 ] Beberapa senyawa reaktif telah diuji untuk tujuan ini, seperti butilen oksida, ortoester, [ 58 ] asetal, trimetil fosfat (TMP), cairan ionik, iodometana (CH 3 I), disikloheksilkarbodiimida (DCC) dan nitril. [ 59 ] Di antara senyawa-senyawa tersebut, nitril (asetonitril, benzonitril, 2-sianopiridina) telah terbukti sangat efektif, terutama ketika digabungkan dengan katalis berbasis cerium. Honda et al. berhasil mencapai hasil DMC 94% dengan selektivitas 96% ketika menggunakan 2-sianopiridina sebagai agen dehidrasi dan CeO 2 sebagai katalis. Lebih jauh, 2-pikolinamida, yang diperoleh dengan hidrasi 2-CP, didehidrasi menggunakan Na 2 O/SiO 2 sebagai katalis, menghasilkan 84% dan menunjukkan selektivitas lebih tinggi dari 99%. [ 31 ]
Dalam penelitian ini, katalis CeO2 dan Ce x Zr1 -xO2 dengan morfologi yang berbeda dan berbagai rasio Ce/Zr disintesis dan diuji, digabungkan dengan 2-sianopiridina (2-CP) sebagai agen dehidrasi, untuk sintesis langsung DEC dari etanol dan CO2 , dalam rangka mengembangkan proses yang dapat beroperasi pada kondisi ringan dengan suhu dan tekanan sedang. Mekanisme sintesis DEC awalnya diselidiki dengan melakukan pengukuran FTIR in situ, menganalisis interaksi katalis dengan karbon dioksida, etanol dan dietil karbonat untuk mengidentifikasi spesies aktif. Untuk menyelidiki lebih lanjut pengaruh potensial morfologi pada hasil yang diperoleh, analisis TEM resolusi tinggi juga dilakukan.
2 Bagian Eksperimen
Katalis CeO2 dan Ce x Zr1-xO2 dengan morfologi yang berbeda disiapkan dengan metode presipitasi dan hidrotermal dan dikarakterisasi dengan berbagai teknik, seperti N2 – physisorption, difraksi sinar-X (XRD), mikroskopi elektron pemindaian emisi medan (FE-SEM), mikroskopi elektron transmisi (TEM), dan analisis desorpsi terprogram suhu (CO2 – TPD dan NH3 – TPD).
2.1 Sintesis Katalis
Katalis disiapkan dengan menggunakan natrium hidroksida (NaOH, 98%) (Merck, Jerman) sebagai agen presipitasi, cerium nitrat heksahidrat (Ce(NO 3 ) 2 ∙6H 2 O, 99%) (Merck, Jerman) sebagai sumber ion cerium, dan zirkonium oksinitrat hidrat (ZrO(NO 3 ) 2 ∙H 2 O, 99%) (Merck, Jerman) sebagai prekursor ion zirkonium.
Untuk sintesis nanorod (R), 20 mL larutan 1 M Ce(NO3 ) 2 ∙ 6H2O dan ZrO(NO3 ) 2 ∙ H2O disiapkan , dengan memberi dosis kedua nitrat pada rasio molar yang tepat. 130 mL larutan NaOH 6 M ditambahkan tetes demi tetes ke dalam nitrat untuk menginduksi presipitasi. Sistem diaduk pada suhu kamar selama 1 jam. Suspensi kemudian dipindahkan ke reaktor autoklaf dan dipanaskan hingga 100 °C selama 24 jam. Setelah mendinginkan reaktor hingga suhu kamar, presipitasi dikenakan siklus sentrifugasi dan pencucian, awalnya dengan air hingga mencapai pH netral dan selanjutnya dengan pencucian etanol akhir.
Untuk sintesis nanocube (C), 10 mL larutan 2 M Ce(NO3 ) 2 ∙ 6H2O disiapkan , dan 70 mL larutan 8 M NaOH. Langkah presipitasi yang sama seperti yang dijelaskan sebelumnya dilakukan setelah suspensi dipindahkan ke reaktor autoklaf dan dipanaskan hingga 180 °C selama 24 jam. Setelah mendinginkan reaktor hingga suhu kamar, presipitasi disentrifugasi dan dicuci seperti yang dijelaskan untuk nanorod.
Parameter sintesis hidrotermal dioptimalkan berdasarkan temuan Piumetti et al. [ 60 ] dengan memvariasikan molaritas NaOH dan suhu reaksi. Pendekatan ini bertujuan untuk memperoleh sampel dengan morfologi yang seragam dan terdefinisi dengan baik.
Nanopartikel (NP) juga disintesis melalui presipitasi, menggunakan 10 mL larutan Ce(NO3)2∙6H2O 4 M dan 70 mL larutan NaOH 2 M. Larutan NaOH ditambahkan tetes demi tetes ke dalam larutan nitrat hingga terjadi presipitasi. Sistem diaduk selama 1 jam. Akhirnya, presipitasi disentrifugasi dan dicuci seperti dijelaskan di atas.
Semua sampel kemudian dikeringkan semalaman pada suhu 70 °C dan selanjutnya dikalsinasi dalam tungku peredam pada suhu 550 °C dengan peningkatan 5 °C/menit selama 2 jam. Untuk memperoleh katalis berbentuk batang dengan luas permukaan yang mirip dengan yang berbentuk kubus, sampel cerium oksida berbentuk batang (CeO 2 -R) menjalani langkah kalsinasi tambahan dalam tungku peredam pada suhu 950 °C dengan peningkatan 5 °C/menit selama 6 jam (CeO 2 -R-C950).
2.2 Karakterisasi Katalis
Fisiosorpsi N 2 dilakukan dengan menggunakan instrumen Micromeritics ASAP TRISTAR 3020. Semua sampel diolah terlebih dahulu pada suhu 200 °C selama 2 jam sebelum pengukuran. Luas permukaan diukur dengan metode Brunauer–Emmett–Teller (BET), sedangkan analisis desorpsi Barrett–Joyner–Halenda (BJH) digunakan untuk menentukan luas pori dan volume pori spesifik.
Sifat struktural katalis diteliti melalui difraksi sinar-X (XRD) dengan difraktometer Panalytical X’pert menggunakan radiasi Cu kα. Difraktogram dikumpulkan pada kisaran 20°≤ 2θ ≤80° dengan laju pemindaian 2,0 °/menit.
Sifat asam dan basa permukaan katalis ditentukan melalui desorpsi terprogram suhu (TPD) menggunakan amonia (NH 3 -TPD) dan karbon dioksida (CO 2 -TPD) sebagai molekul probe. CO 2 -TPD dilakukan dengan instrumen Thermo Scientific TPD/R/O 1100. Sekitar 100 mg bubuk didegaskan dengan 30 mL/menit helium (He) pada 200 °C selama 2 jam, sampel kemudian didinginkan hingga 100 °C dan diolah dengan 30 mL/menit CO 2 selama 30 menit. Selanjutnya, CO 2 yang diserap secara fisik dihilangkan dengan mengalirkan 30 mL/menit He selama 30 menit. Akhirnya, suhu dinaikkan dari 100 hingga 900 °C dengan laju ramp 10 °C/menit dan dipertahankan pada 900 °C selama 30 menit.
NH 3 -TPD dilakukan dalam reaktor tabung kuarsa yang ditempatkan dalam oven vertikal yang dikontrol PID yang terhubung ke modul penganalisis ABB Uras 26 Inframerah untuk kuantifikasi NH 3. Sekitar 300 mg bubuk dimasukkan ke dalam reaktor dan didegaskan dengan 200 mL/menit N 2 pada suhu 250 °C selama 30 menit, kemudian sampel didinginkan hingga 100 °C dan diolah dengan 200 mL/menit 2500 ppm NH 3 dalam aliran helium pada suhu 100 °C selama 30 menit. Selanjutnya, NH 3 yang diserap secara fisik dihilangkan dengan mengalirkan 200 mL/menit N 2 selama 60 menit. Terakhir, TPD dilakukan dengan mengalirkan N 2 200 mL/menit , sementara suhu dinaikkan dari 100 hingga 450 °C pada laju peningkatan 5 °C/menit dan dipertahankan pada 450 °C selama 30 menit.
Mikroskopi elektron pemindaian emisi medan (FE-SEM) dilakukan dalam Zeiss Merlin yang beroperasi dalam mode pencitraan pada tegangan 3 kV dan dilengkapi dengan kolom Gemini II dan detektor Oxford EDX untuk analisis unsur (dilakukan pada 15 kV). Analisis mikroskop elektron transmisi (TEM) dilakukan dengan Thermo Scientific Talos F200X TEM, yang beroperasi pada tegangan 200 kV dan dilengkapi dengan kamera CMOS 16 Mpx. Sampel untuk analisis TEM disiapkan dengan dispersi katalis bubuk dalam propan-2-ol dengan kemurnian tinggi (99,8%) (Merck, Jerman) diikuti oleh sonikasi selama 10 menit dan kemudian diteteskan pada kisi TEM Cu berlapis C berlubang (Agar Scientific, Inggris Raya) yang sebelumnya dibersihkan dengan plasma dalam Ar selama 20 detik.
2.3 Pengaturan Pengujian Eksperimental
Pengujian dilakukan dalam reaktor autoklaf berpengaduk skala laboratorium dengan volume dalam 310 mL. Sebelum percobaan, katalis dikeringkan pada suhu 100 °C semalaman dalam oven pengering. Jumlah katalis optimum (1 g) diidentifikasi berdasarkan data hasil dan produktivitas yang diperoleh melalui penyaringan awal dari 0,1-2 g pemuatan katalis. 2-CP digunakan sebagai agen dehidrasi, yang secara standar digunakan untuk menggeser kesetimbangan termodinamika ke arah produk. [ 61 , 62 ] Jumlah etanol, katalis, dan 2-CP yang diketahui dimuat dalam reaktor, yang kemudian dibersihkan dengan CO 2 tiga kali pada suhu kamar. Sistem reaksi kemudian diberi tekanan hingga 25 bar dengan CO 2 . Setelah waktu stabilisasi, yang diperlukan untuk pelarutan CO 2 dalam etanol, reaktor dipanaskan hingga 130 °C dan diaduk secara mekanis (500 rpm) selama 4 jam. Akhirnya, reaktor didinginkan hingga suhu ruangan dan tekanannya diturunkan. Katalis kemudian dipulihkan melalui penyaringan dan campuran reaksi dianalisis pada GC-MS Agilent 7890A yang dilengkapi dengan kolom kapiler HP5 MS (0,25 mm × 30 m × 0,25 µm) dan diukur pada GC-FID 8890 yang dilengkapi dengan kolom kapiler CP-sil 8 CB (0,32 mm × 25 m × 5 µm).
Persamaan berikut diterapkan untuk menentukan konversi, selektivitas, dan hasil, di mana n in dan n fin masing-masing adalah mol awal dan akhir dari senyawa tertentu yang ada dalam reaktor, sementara EP dan EC masing-masing merupakan etil pikolinat dan etil karbamat, yang merupakan produk sampingan reaksi utama.

Uji daur ulang dilakukan untuk katalis yang paling aktif. Setelah setiap pengujian, katalis dicuci secara menyeluruh dengan etanol dan air suling, yang kemudian dihilangkan dengan mengeringkan katalis semalaman pada suhu 70 °C.
2.4 Investigasi FTIR In Situ
Pengukuran FTIR dilakukan dengan spektrometer Bruker Invenio S yang dilengkapi dengan detektor merkuri kadmium telurida dan sel kuarsa dengan jendela KBr transparan. Spektrum FTIR in situ dikumpulkan dalam mode transmisi sambil memperkenalkan peningkatan jumlah molekul probe dalam sel IR yang berisi katalis, yang sebelumnya ditekan ke dalam cakram tipis. Sebelum pengukuran, katalis diolah terlebih dahulu dalam vakum pada 300 °C, mencapai suhu ini dengan laju pemanasan 5 °C/menit dan mempertahankannya selama 30 menit. Semua spektrum dikurangi sehubungan dengan spektrum katalis yang disintesis, dikumpulkan pada 25 °C setelah praperlakuan dan sebelum mengirim molekul probe ke sel. CO 2 , etanol, dan DEC digunakan sebagai molekul probe. Spektrum FTIR direkam pada peningkatan tekanan molekul probe. Kemudian, untuk mengidentifikasi spesies yang paling aktif, dilakukan studi FTIR terhadap penyerapan etanol diikuti dengan penyerapan CO 2 : setelah etanol dikirim ke sampel, etanol yang diserap secara fisik dikeluarkan dengan cara dievakuasi dan kemudian sejumlah CO 2 yang semakin banyak dikirim ke sel IR. Spektrum IR yang terkumpul kemudian dinormalisasi terhadap densitas cakram katalis.
3 Hasil dan Pembahasan
3.1 Sifat Struktur dan Morfologi Katalis
Gambar 1a melaporkan perbandingan pola XRD yang diperoleh pada katalis yang disintesis. Semua sampel menunjukkan struktur kubik fluorit, khas untuk cerium oksida, dan turunannya [ 63 ] dengan sinyal karakteristik pola CeO 2 (JCPDF00-004-0593). Saat memeriksa katalis Ce-Zr-O, tidak ada puncak yang terkait dengan keberadaan fase zirkonium oksida monoklinik dan tetragonal yang terdeteksi, yang mungkin menunjukkan bahwa Zr berhasil didoping ke dalam struktur kisi ceria. Pengukuran SEM-EDX mengonfirmasi rasio doping yang diinginkan untuk semua sampel dengan hanya sedikit penyimpangan (± 0,015) dari rasio unsur yang dituju untuk semua komposisi Ce-Zr-O yang ditargetkan (Tabel S1 dan Gambar S1–S4 dalam Informasi Pendukung). Nanopartikel dan katalis berbentuk batang menunjukkan puncak XRD yang lebih luas karena ukuran kristalit yang lebih rendah, sedangkan puncak tajam untuk kubus menunjukkan dimensi partikel yang lebih besar, yang dikonfirmasi oleh TEM dan SEM (Gambar 1b,c , S5,S6 , dan Tabel S2 ).

Gambar 1
Buka di penampil gambar
Kekuatan Gambar
(a) Pola XRD dari sampel CeO2 dan CeO2 terdoping Zr dengan morfologi berbeda yang dijelaskan dalam penelitian ini: NP (nanopartikel), C (nanokubus), dan R (nanorod); (b) Gambar TEM dari sampel ceria NP, R, dan C yang menunjukkan bentuk berbeda yang diperoleh; (c) Karakterisasi SEM dari distribusi morfologi sampel-sampel ini.
Analisis SEM dan TEM juga mengungkapkan bahwa nanopartikel menunjukkan ukuran partikel yang seragam, sedangkan batang dan kubus memiliki ketidakhomogenan yang lebih besar (Gambar S5, S6 ). Untuk sampel CeO2 yang didoping Zr , meskipun terjadi penurunan ukuran batang dengan peningkatan kandungan Zr, morfologi batang tetap dipertahankan di seluruh jumlah doping Zr (Gambar 1c dan S7 ).
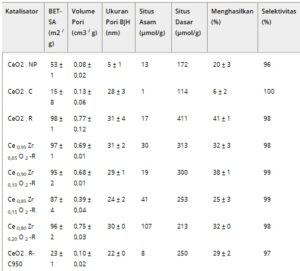
Seperti yang dilaporkan dalam Tabel 1 , sifat tekstur katalis dipengaruhi oleh metode sintesis. Katalis nanorod menunjukkan luas permukaan dan volume pori tertinggi, sementara nanocube menunjukkan luas permukaan terendah dan volume pori yang agak rendah (isoterm fisisorpsi sampel dilaporkan dalam Gambar S8–S15 ). Selain itu, doping dengan zirkonium mengakibatkan penurunan luas permukaan, yang sejalan dengan data literatur. [ 42 ] Kalsinasi katalis seperti batang (CeO 2 -R) pada 950 °C menunjukkan kemanjuran yang luar biasa dalam mengurangi luas permukaannya ke tingkat yang sebanding dengan katalis CeO 2 -C.
Tabel 1. Luas permukaan BET (BET-SA), sifat pori, sifat asam dan basa, dan aktivitas katalitik dari katalis yang dijelaskan dalam penelitian ini.
Kondisi reaksi: Jumlah etanol: 860 mmol, jumlah 2-CP: 430 mmol, jumlah katalis: 1 g, tekanan CO2 pada suhu 25 °C: 25 bar, suhu: 130 °C, waktu: 4 jam, kecepatan pengadukan: 500 rpm.
3.2 Sifat Asam-Basa Katalis
Karena keberadaan situs asam dan basa telah dilaporkan memengaruhi aktivitas katalis terhadap konversi dari CO 2 ke DEC [ 24 , 39 ] sampel yang disintesis kemudian diuji dengan CO 2 – dan NH 3 -TPD. Semua sampel menunjukkan puncak desorpsi CO 2 yang intens antara 50 dan 200 °C (Gambar S16a ), terkait dengan situs basa lemah, [ 38 ] kecuali katalis CeO 2 -C, serta sejumlah kecil situs basa sedang-kuat (puncak dari 250 hingga 500 °C). [ 38 ] Total kebasaan yang dihitung untuk setiap katalis dilaporkan dalam Tabel 1 dan menunjukkan bahwa kebasaan menurun dalam urutan berikut: berbentuk batang > nanopartikel > berbentuk kubus. Sampel CeO 2 -R menunjukkan jumlah situs basa spesifik tertinggi (411 µmol/g) sementara, dengan meningkatkan kandungan Zr, kebasaan menurun secara progresif.
Sifat asam dari sampel diselidiki oleh NH 3 -TPD (Gambar S16b ). Menariknya, perilaku asam dipengaruhi oleh morfologi katalis dan kandungan zirkonium. Hampir tidak ada situs asam yang terdeteksi dalam sampel CeO 2 -C, mungkin karena luas permukaannya yang rendah. CeO 2 -NP menunjukkan distribusi bimodal yang terkait dengan keberadaan situs asam kekuatan lemah dan sedang, sementara CeO 2 -R menunjukkan jumlah situs asam tertinggi di antara katalis ceria yang tidak didoping. Peningkatan pemuatan Zr efektif dalam meningkatkan keasaman katalis sambil mengurangi kebasaan, dan sampel Ce 0,80 Zr 0,20 O 2 -R menunjukkan jumlah situs asam spesifik tertinggi (107 µmol/g) seperti yang dilaporkan dalam Tabel 1 .
3.3 Uji Aktivitas Katalitik
Uji katalitik dari sampel yang disintesis dilakukan pada 130 °C dan tekanan CO2 25 bar selama 4 jam dan aktivitas katalitik semua sampel dibandingkan dalam Tabel 1. Nilai selektivitas yang tinggi diperoleh dengan semua katalis, di antaranya katalis CeO2 – NP menunjukkan nilai terendah (96%). Produk sampingan utamanya adalah etil pikolinat, yang dapat diproduksi setelah reaksi etanol dengan 2-pikolinamida. Katalis berbentuk batang menunjukkan kinerja terbaik dengan hasil bervariasi dari 25 hingga 40%, sedangkan CeO2 – NP dan CeO2 – C menunjukkan aktivitas terendah dengan hasil masing-masing 20% dan 6%. Demi perbandingan, uji katalitik tanpa adanya 2-CP juga dilakukan untuk memastikan bahwa tren aktivitas katalitik yang diperoleh akan analog meskipun hasilnya jauh lebih rendah (Tabel S4 ). Hasil ini sejalan dengan yang diperoleh oleh berbagai penulis yang mempelajari sintesis DMC. [ 56 , 64 ]
Seperti yang sering dilaporkan dalam literatur, sejumlah besar situs asam dan basa diperlukan untuk meningkatkan hasil reaksi, [ 65 – 67 ] asalkan ini tidak terlalu kuat. [ 68 ] Namun, meskipun terjadi peningkatan keasaman yang disebabkan oleh doping Zr (Tabel 1 ), tidak ada peningkatan yang signifikan dalam aktivitas katalitik yang diamati dan sampel ceria murni berbentuk batang (CeO 2 -R) menunjukkan kinerja terbaik. Liu et al. [ 66 ] mengamati perilaku yang berbeda dan mengaitkan aktivitas yang lebih tinggi dari sampel Zr 0,1 Ce dengan keberadaan kekosongan oksigen yang lebih besar. Sementara penelitian kami juga mengeksplorasi korelasi ini (lihat Gambar S17–S24 dan Tabel S3 ), kami tidak menemukan bukti konklusif untuk mengonfirmasinya.
Bahkan jumlah situs asam tertinggi dari sampel Ce 0,80 Zr 0,20 O 2 -R tampaknya tidak memiliki efek yang berarti pada hasil (lihat Tabel 1 ). Sampel ini juga diuji untuk kemungkinan pelindian Zr setelah uji katalitik 4 jam dan 8 jam, dengan hasil yang menunjukkan sedikit penurunan kandungan Zr, dari 0,24 menjadi 0,7 setelah uji katalitik terpanjang (Tabel S5 dan Gambar S25 ). Sebaliknya, korelasi dapat ditemukan antara kebasaan dan hasil, yang menunjukkan bahwa situs basa berkekuatan lemah dan sedang meningkatkan aktivitas (Gambar S26 ). Gao et al. [ 69 ] melaporkan pengamatan serupa dalam percobaan mereka, yang menunjukkan bahwa aktivitas bergantung secara linear pada jumlah situs basa daripada bergantung secara linear pada keasaman atau rasio antara keasaman dan kebasaan.
Untuk memverifikasi apakah hasil katalitik yang diperoleh hanya ditentukan oleh luas permukaan yang lebih tinggi dari sampel berbentuk batang, percobaan pembuktian konsep dilakukan dengan mengkalsinasi sampel CeO 2 -R berkinerja terbaik hingga 950 °C, yang menghasilkan luas permukaan yang menurun secara signifikan (Tabel 1 ). Ketika diuji untuk konversi CO 2 dan etanol menjadi DEC, sampel ini menunjukkan hasil yang jauh lebih tinggi dibandingkan dengan cerium oksida berbentuk kubus (masing-masing 29,2 versus 6,2%), meskipun luas permukaan yang diukur serupa (23 versus 15 m 2 /g) seperti yang dilaporkan dalam Tabel 1 .
Banyak karya yang menunjukkan bahwa reaktivitas katalitik CeO2 juga dapat dikaitkan dengan keberadaan kekosongan oksigen atau rasio Ce3 + /Ce4 + . [ 35 , 70-73 ] Sekalipun peran mereka dalam reaksi saat ini tidak dapat diabaikan sepenuhnya, kation Ce3 + tidak mungkin terlibat karena reaksi ini terjadi dalam kondisi ringan dan tidak mereduksi. Di sisi lain, kekosongan oksigen dapat bertindak sebagai situs basa yang mampu menyerap CO2 sebagai karbonat. Oleh karena itu, situs asam dan basa diharapkan untuk mengkatalisis reaksi ini. Hasil serupa yang diperoleh saat menguji sampel Ce 0,85 Zr 0,15 O 2 -R dan CeO 2 -R-C950 (yang memiliki jumlah situs basa yang sama) menguatkan hipotesis ini, karena hasil yang sangat mirip diperoleh untuk sampel-sampel ini (masing-masing 25,3% versus 29,2%), meskipun luas permukaan yang diukur untuk sampel berbentuk batang yang dikalsinasi pada 950 °C jauh lebih rendah (23,0 m 2 /g versus 87,2 m 2 /g untuk Ce 0,85 Zr 0,15 O 2 -R). Meskipun demikian, hasil-hasil ini menunjukkan bahwa morfologi tampaknya memengaruhi jumlah situs basa yang diperoleh, dan, sebagai akibatnya, aktivitas katalitik: memang, semua sampel berbentuk batang melaporkan jumlah situs basa yang lebih tinggi dibandingkan dengan sampel berbentuk bola dan kubus (Tabel 1 ), sejalan dengan temuan sebelumnya oleh Wang dkk. [ 64 ]
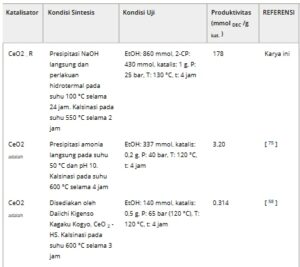
Tabel 2 membandingkan hasil studi ini dengan kinerja katalitik yang dilaporkan sebelumnya untuk sintesis langsung DEC, dinyatakan sebagai produktivitas katalis (mmol DEC /g kat. ). Penggunaan agen pendehidrasi meningkatkan produktivitas secara signifikan dibandingkan dengan reaksi yang dilakukan tanpa agen tersebut. Selain itu, agen pendehidrasi reaktif seperti 2-sianopiridina, butilena oksida, dan trietil ortoasetat terbukti lebih efektif daripada alternatif nonreaktif seperti saringan molekuler, yang menghasilkan nilai produktivitas yang dua kali lipat lebih rendah. [ 22 , 39 , 74 ] Giram et al. juga mengamati aktivitas yang lebih tinggi untuk katalis CeO2 dibandingkan dengan oksida campuran Ce-Zr. Sementara perbandingan langsung sulit dilakukan karena perbedaan parameter reaksi, sampel CeO2 – R menunjukkan produktivitas yang relatif dekat dengan yang dilaporkan oleh Giram et al., meskipun reaksinya dilakukan pada tekanan dua kali lipat. Hal ini menunjukkan bahwa CeO2 – R mungkin memiliki sifat yang menguntungkan dalam kondisi yang digunakan dalam studi ini.
Tabel 2. Kinerja katalitik berbagai katalis dalam sintesis langsung DEC, seperti yang dilaporkan dalam penelitian sebelumnya dan penelitian saat ini.
3.4 Investigasi Mekanistik Melalui FTIR In Situ
Analisis FTIR in situ dilakukan untuk menyelidiki apakah morfologi berperan dalam mekanisme reaksi. Untuk penyelidikan FTIR ini, sampel CeO 2 -R dan CeO 2 -C dipilih, karena masing-masing menunjukkan aktivitas tertinggi dan terendah.
Pertama, kedua katalis tersebut terekspos pada peningkatan tekanan molekul probe, yaitu CO 2 , etanol, dan DEC; hasil terperinci tentang spesies yang terbentuk pada sampel dilaporkan dalam Informasi Pendukung (Gambar S27–S32 , Tabel S6 dan S7 ). Secara singkat, CO 2 sebagian besar mengadsorpsi pembentukan bikarbonat dan karbonat bidentat pada kedua material; karbonat monodentat dan polidentat juga muncul, tetapi dalam proporsi yang lebih kecil. Adsorpsi etanol pada dua sampel CeO 2 menghasilkan tiga jenis spesies etoksi: (i) etoksi monodentat, juga dikenal sebagai berdiri atau tipe I, (ii) etoksi bidentat, juga dikenal sebagai berbaring atau tipe II, dan (iii) etoksi tridentat, juga dikenal sebagai tipe III. Spesies monodentat, yang lebih labil, lazim pada CeO 2 -R, sedangkan etoksi tipe II dan tipe III, lebih stabil, lebih disukai terbentuk pada CeO 2 -C.
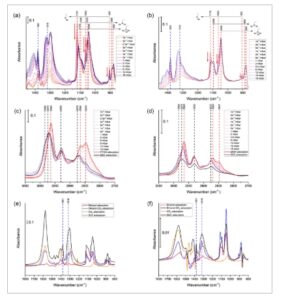
Kemudian, untuk mengidentifikasi spesies yang paling aktif dan menjelaskan kemungkinan perbedaan dalam mekanisme reaksi untuk dua katalis yang dianalisis, studi FTIR in situ dari adsorpsi etanol diikuti oleh adsorpsi CO 2 dilakukan. Ketika dua katalis ceria dengan etanol yang telah diserap sebelumnya terkena CO 2 , spektrum FTIR berubah secara signifikan. Dari Gambar 2a , dapat diamati bahwa pita pada 1121, 1063, dan 905 cm −1 , yang disebabkan oleh spesies etoksi tipe I, [ 50 , 52 ] menurun secara signifikan, sedangkan intensitas pita pada 1103, 1053, 888, dan 882 cm −1 hanya menunjukkan sedikit penurunan. Katalis CeO 2 -C juga menunjukkan tren yang sama seperti yang diilustrasikan pada Gambar 2b . Ini menunjukkan bahwa etoksi tipe I bisa lebih reaktif daripada spesies etoksi lainnya dalam kasus yang disajikan di sini. Dalam rentang frekuensi 1800–1200 cm −1 , pita pada 1575, 1475, 1402, 1381, 1318, dan 1300 cm −1 ditemukan meningkat. Meskipun pita pada 1575, 1402, dan 1300 mungkin juga terkait dengan adsorpsi CO 2 dengan pembentukan karbonat bidentat dan spesies bikarbonat (lihat Tabel S6 ), pita pada 1381 dan 1318 cm −1 hanya ada dalam spektrum adsorpsi DEC seperti yang disorot dalam Gambar 2e dan Gambar 2f ; karenanya, pita ini dapat dikaitkan dengan pembentukan dietil karbonat atau dikaitkan dengan monoetil karbonat sebagai perantara reaksi. Akan tetapi, disarankan bahwa produksi perantara lebih disukai dan DEC tidak terdeteksi mengingat kondisi analitis tekanan rendah. [ 66 , 76 ] Berbagai penelitian tentang mekanisme reaksi DMC menunjukkan bahwa mengamati fitur DMC merupakan tantangan dalam kondisi eksperimen yang umum karena konsentrasinya yang rendah. Meskipun demikian, menurut prinsip mikroreversibilitas, dekomposisi suatu senyawa harus mengikuti langkah-langkah dasar yang sama yang mengarah pada sintesisnya. [ 77 ] Akibatnya, disosiasi DEC pada permukaan dapat mengungkapkan zat antara yang diperlukan untuk menghasilkan DEC. Saran tersebut muncul dari pengamatan selama adsorpsi dietil karbonat pada katalis (Lihat Gambar S31 dan S32)), yang mengungkap sinyal bilangan gelombang spesifik yang terkait dengan keberadaan etoksi dan karbonat. Hal ini menunjukkan bahwa dietil karbonat mengalami disosiasi awal menjadi etoksi dan monoetil karbonat, diikuti oleh pemecahan selanjutnya menjadi karbonat dan etoksi. Berdasarkan percobaan yang disajikan di sini, kami berspekulasi bahwa frekuensi yang tidak ditetapkan (1381 dan 1318 cm −1 ) sesuai dengan zat antara monoetil karbonat.
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Spektrum FTIR dari adsorpsi CO2 pada etanol pra-adsorpsi dalam rentang frekuensi 1460–860 cm −1 pada (a) katalis CeO2 – R dan (b) katalis CeO2 – C (garis putus-putus merah sesuai dengan sinyal yang terkait dengan adsorpsi etanol, sedangkan garis putus-putus biru menunjukkan sinyal yang muncul dari reaksi CO2 + etanol, yang mengarah pada pembentukan DEC atau zat antara monoetil karbonat); Spektrum FTIR dari adsorpsi CO2 pada etanol pra-adsorpsi dalam rentang frekuensi 3050–2750 cm −1 pada (c) katalis CeO2 – R dan (d) katalis CeO2 – C (garis putus-putus hitam mengacu pada frekuensi IR regangan CH x dari DEC yang teradsorpsi, sedangkan garis putus-putus merah sesuai dengan regangan CH x dari etanol yang teradsorpsi); perbandingan spektrum IR dari semua percobaan in situ yang dilakukan untuk (e) katalis CeO 2 -R dan (f) katalis CeO 2 -C, dengan masing-masing spektrum sesuai dengan tekanan tertinggi molekul probe yang dikirim ke katalis untuk etanol, CO 2 , DEC, dan etanol + CO 2 .
Pembentukan intermediet juga dapat diverifikasi dengan membandingkan spektrum FTIR dari penyerapan etanol-CO2 dengan penyerapan DEC pada katalis batang dalam kisaran νCH x (3000–2800 cm −1 ). Seperti dilaporkan dalam Gambar 2c , dengan meningkatkan tekanan CO2 , pergeseran puncak bertahap dari frekuensi peregangan CH x yang terkait dengan penyerapan etanol ke peregangan CH x yang terkait dengan penyerapan DEC diamati. Memang, spektrum FTIR yang dikumpulkan pada pemuatan CO2 tinggi hampir identik dengan spektrum penyerapan DEC. Dengan demikian, mengamati spektrum FTIR di wilayah ini memungkinkan untuk mengidentifikasi jalur reaksi untuk katalis batang.
Investigasi yang sama dilakukan untuk katalis CeO 2 -C (lihat Gambar 2d ): dengan meningkatkan jumlah CO 2 , pergeseran puncak dari puncak yang terkait dengan adsorpsi etanol ke puncak yang terkait dengan adsorpsi DEC juga diamati dalam kasus ini. Namun, spektrum akhir mempertahankan lebih banyak kesamaan dengan spektrum adsorpsi etanol daripada dengan DEC, yang menunjukkan adanya spesies etoksi yang tidak bereaksi secara signifikan pada permukaan katalis. Ini dapat diverifikasi dengan menganalisis spektrum kedua katalis saat melakukan adsorpsi etanol in situ (Gambar S29 dan S30 ). Secara khusus, etanol berinteraksi dengan permukaan katalis dengan menghasilkan spesies etoksi. Menurut beberapa karya, pita-pita ini dapat dihasilkan oleh disosiasi etanol pada permukaan CeO 2 menjadi dua jenis spesies etoksi dengan stabilitas termal yang berbeda. Etoksi monodentat lebih labil ( E ads = −0,95 eV), sedangkan etoksi bidentat adalah spesies yang lebih stabil ( E ads = −2,68 eV). [ 52 ] Perhitungan DFT menunjukkan bahwa jenis spesies etoksi lain juga dapat diperoleh ketika etanol teradsorpsi pada permukaan CeO 2 yang terhidroksilasi , dinamakan etoksi tipe III, yang merupakan tipe tridentat. [ 50 ] Dari kedua spektrum, dapat dicatat bahwa sampel CeO 2 -C menunjukkan adanya lebih banyak gugus etoksi tipe III daripada tipe I; spesies pertama tidak bereaksi dengan CO 2 untuk menghasilkan DEC karena intensitas puncak terkait (1046 dan 880 cm −1 ) tetap tidak berubah, seperti yang terlihat pada Gambar 2b .
3.5 Menyelidiki Peran Morfologi Melalui Mikroskop Elektron Resolusi Tinggi dan Analisis FFT
Untuk memahami kemungkinan peran morfologi dalam hasil katalitik yang diamati dan penjelasan mekanistik, morfologi kedua katalis diperiksa lebih lanjut dengan analisis TEM. Ketika mencitrakan katalis batang pada resolusi tinggi, beberapa ketidakteraturan ditemukan. Cacat ini, yang muncul sebagai area dengan kontras lebih rendah seperti yang dapat dilihat pada Gambar 3 , sebaliknya tidak ada dalam kubus ceria dan nanopartikel. Menariknya, keberadaan cacat tersebut juga ditemukan cukup jelas dalam katalis CeO 2 -R-C950. Baru-baru ini, telah diusulkan bahwa kimia cacat dalam CeO 2 dapat memainkan peran penting dalam meningkatkan aktivitasnya ketika digunakan untuk beberapa reaksi katalitik. [ 78 – 81 ] Pekerjaan sebelumnya telah menunjukkan bahwa rongga dalam nanorod ceria dikembangkan melalui agregasi kekosongan oksigen dalam tubuh nanorod selama sintesis. [ 82 ] Hal ini sejalan dengan penelitian kami, karena pada sampel CeO 2 -R-C950 diamati rongga yang lebih besar dan memanjang, yang menurut penelitian sebelumnya terbentuk melalui agregasi rongga yang berdekatan pada suhu yang lebih tinggi, yang bertujuan untuk meminimalkan energi permukaan secara keseluruhan. [ 83 ] Oleh karena itu, temuan ini akan menjelaskan aktivitas katalis yang lebih tinggi yang diamati dibandingkan dengan CeO 2 berbentuk kubus , meskipun luas permukaannya serupa, yang menunjukkan bahwa cacat tersebut bertanggung jawab atas peningkatan kinerja katalitik.

Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Gambar TEM dan FFT dari (a) dan (b) katalis CeO 2 -C, menunjukkan permukaan kontras homogen, (c) dan (d) katalis CeO 2 -R, dan (e) dan (f) katalis CeO 2 -R-C950 yang cacat kontras rendahnya diamati secara luas di seluruh area yang dianalisis.
Oleh karena itu, analisis Fast Fourier Transform (FFT) dilakukan pada gambar yang diperoleh untuk menyelidiki kemungkinan korelasi pembentukan rongga dengan faset kristal tertentu. Analisis menunjukkan secara istimewa bidang (100) untuk katalis CeO 2 -C, sementara faset yang terekspos (111) dan (110) terutama ditemukan untuk katalis CeO 2 -R. Penelitian sebelumnya telah mengorelasikan keberadaan cacat permukaan dengan struktur kristal dan faset yang terekspos dari bahan berbasis CeO 2 – , berdasarkan energi pembentukan cacat oksigen yang berbeda untuk bidang kristal yang berbeda. [ 84 , 85 ] Secara khusus, telah diusulkan oleh temuan eksperimental dan DFT bahwa bidang kristal (110) memiliki energi pembentukan kekosongan oksigen yang lebih rendah dibandingkan dengan faset (100) dan (111), akibatnya menghasilkan jumlah cacat oksigen yang lebih tinggi, dan karenanya meningkatkan reaktivitas dan kinerja katalitik.
Selain itu, Gambar 3e dan 3f menunjukkan bahwa lubang yang lebih besar diperoleh untuk sampel yang dikalsinasi pada suhu yang lebih tinggi (950 °C); rongga ini menunjukkan simetri dengan faset yang terdefinisi dengan jelas, terutama konsisten dengan {100}-oktahedra terpotong {111}. Pinggiran kisi melintasi wilayah rongga dengan mempertahankan orientasi yang sama dan tidak ada bukti pola moiré, yang menyiratkan bahwa rongga ini tertutup di dalam butiran kristal tunggal, daripada terdiri dari butiran yang lebih kecil yang akan menunjukkan kontras yang berbeda karena efek tidak fokus. Fitur ini karenanya menunjukkan bahwa struktur kristal tunggal tetap kontinu meskipun ada cacat. Brambila et al. mempelajari evolusi rongga dengan suhu kalsinasi dalam sampel cerium oksida berbentuk batang dan kubus, dan mereka mengevaluasi melalui simulasi DFT jumlah energi yang dibutuhkan untuk menghilangkan oksigen dari permukaan nanoceria. Pekerjaan mereka menunjukkan bahwa mengekstraksi oksigen permukaan dari nanorod dengan rongga secara termodinamika lebih mudah dibandingkan dengan nanorod ceria yang tidak memiliki rongga. [ 82 ] Lebih jauh, penelitian sebelumnya telah menunjukkan bahwa tepi langkah paling stabil dari pulau-pulau nano dan lubang-lubang pada permukaan ceria (111) bersesuaian dengan faset (110) dan (100). [ 86 ] Ketika diuji untuk adsorpsi metanol, ini ditemukan berfungsi sebagai situs aktif, di mana metanol terdisosiasi untuk membentuk metoksi pada tepi langkah yang menyerupai faset (110) dan menjembatani metoksi pada faset yang menyerupai faset (100). [ 86 ] Akibatnya, simulasi menunjukkan bahwa rongga mengaktifkan permukaan {111}. Menurut hasil ini, karena katalis batang kami sebagian besar mengekspos bidang kristal (110) dan (111) yang rusak, temuan serupa dapat ditarik pada disosiasi etanol pada nanorod ceria. Dengan demikian, hasil kami menunjukkan bahwa etanol teradsorpsi pada faset ini secara istimewa sebagai etoksi tipe I, sementara pada bidang (100) pembentukan etoksi yang menjembatani dan terkoordinasi tiga sebagian besar disukai. [ 87 ] Aktivitas tertinggi dari katalis cerium oksida berbentuk batang dapat dikaitkan dengan keberadaan cacat struktur mesopori, seperti rongga-rongga kosong yang berkelompok dan terbentuk secara khusus pada sisi-sisi tertentu.
Berdasarkan hasil ini, mekanisme reaksi yang mungkin diajukan untuk sintesis DEC dengan katalis CeO 2 -R, seperti yang diilustrasikan dalam Gambar 4. Menurut ini, spesies etoksi tipe I yang teradsorpsi pada cacat permukaan katalis bereaksi dengan spesies karbonat bidentat atau bikarbonat yang teradsorpsi untuk menghasilkan monoetil karbonat. Akhirnya, interaksi mereka dengan spesies etoksi lain menghasilkan DEC dan air. Mekanisme yang sebanding telah diajukan untuk katalis CeO 2 -C pada Gambar 5 : perbedaan utamanya adalah disosiasi etanol menjadi etoksi tipe III untuk katalis ini, dan adsorpsi CO 2 yang terbatas pada bidang (100), yang menghasilkan pembentukan intermediet yang berkurang dan, akibatnya, produksi dietil karbonat yang lebih rendah.
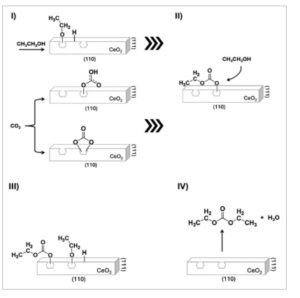
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Skema mekanisme reaksi yang diusulkan pada katalis CeO 2 -R.
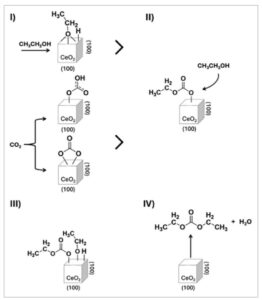
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Skema mekanisme reaksi yang diusulkan pada katalis CeO 2 -C.
3.6 Investigasi Stabilitas Katalis
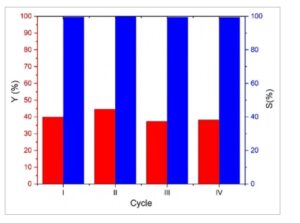
Akhirnya, untuk memverifikasi kemungkinan penggunaan kembali katalis berkinerja terbaik yang disajikan dalam karya ini, uji daur ulang dilakukan pada kondisi operasi yang sama untuk katalis CeO 2 -R, yang menunjukkan aktivitas katalitik tertinggi. Seperti yang ditunjukkan pada Gambar 6 , kinerja katalitik dipertahankan selama empat siklus berurutan dengan hanya sedikit penurunan dalam selektivitas (dari 99,6% untuk siklus I menjadi 99,4% setelah siklus IV). Hasil ini menyoroti stabilitas katalis yang sangat baik, karena mempertahankan aktivitas dan selektivitasnya selama beberapa penggunaan, membutuhkan penggantian yang lebih jarang dan menunjukkan kelayakan dan keberlanjutan yang menjanjikan dalam skenario aplikasi nyata.
Gambar 6
Buka di penampil gambar
Kekuatan Gambar
Uji daur ulang untuk katalis CeO 2 -R. (Jumlah etanol: 0,86 mol, jumlah 2-CP: 0,43 mol, jumlah katalis: 1 g, P CO2 pada suhu 25 °C: 25 bar, suhu: 130 °C, waktu: 4 jam, kecepatan pengadukan: 500 rpm.)
4 Kesimpulan
Dalam pekerjaan ini, katalis berbasis cerium dengan morfologi yang berbeda disintesis melalui metode presipitasi dan sintesis hidrotermal dan kemudian diuji untuk sintesis langsung DEC dari etanol dan CO 2 . Metode sintesis mempengaruhi sifat-sifat katalis, dan morfologi ditemukan memainkan peran kunci dalam aktivitas katalitik terhadap sintesis langsung DEC. Katalis berbasis ceria batang menunjukkan aktivitas katalitik tertinggi diikuti oleh nanopartikel dan ceria berbentuk kubik. Meskipun doping dengan Zr efektif dalam meningkatkan karakter asam katalis, oksida campuran Ce-Zr menunjukkan aktivitas yang lebih rendah sehubungan dengan katalis batang ceria murni; sampel yang terakhir dicirikan oleh jumlah situs basa yang lebih tinggi, menunjukkan bahwa keasaman memainkan peran sekunder dibandingkan dengan kebasaan.
Untuk memahami mekanisme di balik aktivitas katalitik, investigasi FTIR in situ dilakukan pada katalis CeO 2 -R dan CeO 2 -C, masing-masing menunjukkan aktivitas katalitik tertinggi dan terendah. Hasil penelitian menunjukkan bahwa etoksi tipe I lebih reaktif daripada spesies etoksi lainnya, karena sinyal FTIR dari etoksi tipe I cepat menghilang ketika meningkatkan tekanan CO 2 , yang menunjukkan konversinya. Perbedaan utama antara kedua katalis ditemukan dalam mekanisme aktivasi etanol, dengan pembentukan spesies etoksi tipe I dan II untuk batang CeO 2 , sedangkan spesies etoksi tipe II dan III untuk CeO 2 berbentuk kubus . Untuk mengatasi kurangnya pemahaman tentang adsorpsi DEC pada permukaan CeO 2 , ini juga diselidiki, karena mempelajari spektrum FTIR di wilayah νCH x dapat berguna untuk memahami apakah produksi DEC telah terjadi. Hasil baru kami memang memungkinkan kami untuk mengidentifikasi dan memahami jalur reaksi yang berbeda untuk katalis berbentuk batang dan kubus. Akhirnya, analisis TEM dan FFT resolusi tinggi dilakukan untuk menyelidiki alasan di balik perbedaan ini. Kami menemukan bahwa cacat struktural yang luas hadir dalam katalis berbentuk batang, yang sebaliknya tidak ada dalam ceria berbentuk kubus. Dengan menggabungkan hasil penyelidikan keasaman-kebasaan, mekanistik, dan struktural, kami dapat memahami aktivitas katalitik superior yang diamati yang ditunjukkan oleh sampel berbentuk batang dengan kinerja terbaik, yang terbukti aktif dan stabil bahkan setelah empat uji katalitik berturut-turut. Secara keseluruhan, hasil ini menjelaskan keuntungan dari penyetelan morfologi dan kimia cacat katalis berbasis CeO 2 untuk penggunaan yang paling efisien dalam sintesis langsung DEC dari etanol dan CO 2 .
