ABSTRAK
Diacylglycerol O-acyltransferase 1 (DGAT1) merupakan protein membran integral yang menggunakan asil-koenzim A (asil-CoA) dan diasilgliserol (DAG) untuk mengkatalisis pembentukan triasilgliserida (TAG). Reaksi transfer asil terjadi antara gugus karboksilat aktif dari asam lemak dan gugus hidroksil bebas pada tulang punggung gliserol DAG. Namun, bagaimana kedua substrat memasuki ruang reaksi katalitik DGAT1 dan berinteraksi dengan DGAT1 masih belum jelas. Penelitian ini bertujuan untuk mengeksplorasi dasar struktural pengenalan substrat DGAT1 dengan menyelidiki jalur masing-masing substrat ke ruang reaksi. Dengan menggunakan struktur cryo-EM DGAT1 manusia dalam kompleks dengan substrat oleoil-CoA, kami merancang dua sistem simulasi dinamika molekuler (MD) semua atom yang berbeda: DGAT1 menjauh (baik asil-CoA dan DAG menjauh dari ruang reaksi) dan terikat DGAT1 (asil-CoA terikat di dalam dan DAG menjauh dari ruang reaksi). Simulasi DGAT1 menjauh kami mengungkapkan bahwa asil-CoA mendekati ruang reaksi melalui interaksi dengan residu bermuatan positif dalam heliks transmembran 7. Simulasi terikat DGAT1 menunjukkan DAG memasuki ruang reaksi dari selebaran sitosol. Asam lemak asil-CoA yang terikat sejajar dengan gugus kepala DAG, yang tampaknya kompeten untuk pembentukan TAG. Kami kemudian mengubahnya menjadi TAG dan koenzim (CoA) dan menggunakan simulasi gaya bias adaptif (ABF) untuk mengeksplorasi jalur keluar produk. Kami mengidentifikasi rute pelariannya, yang selaras dengan jalur masuknya masing-masing. Visualisasi jalur substrat dan produk serta interaksinya dengan DGAT1 diharapkan dapat memandu desain eksperimen masa depan untuk lebih memahami struktur dan fungsi DGAT1.
1 Pendahuluan
Penyimpanan cadangan energi yang tepat sangat penting untuk kelangsungan hidup semua organisme hidup, berfungsi sebagai persiapan untuk kondisi menantang yang mungkin terjadi di masa depan. Triasilgliserol (TAG) merupakan bentuk penyimpanan energi yang paling efisien dan umum digunakan, terdiri dari tiga rantai asil yang diesterifikasi ke tulang punggung gliserol [ 1 , 2 ]. TAG umumnya diproduksi di retikulum endoplasma (ER) hati dan jaringan adiposa melalui serangkaian langkah yang disebut jalur Kennedy [ 3 , 4 ]. Pada fase akhir jalur ini, diacylglycerol O-acyltransferase 1 (DGAT1) bertanggung jawab atas reaksi enzimatik untuk mengubah diacylglycerol (DAG) dan asil-CoA menjadi TAG dan CoA dengan mentransfer gugus asil dari asil-CoA ke posisi sn -3 DAG. Produksi TAG tersebut kemudian dapat disimpan dalam tetesan lipid untuk fungsi tertentu [ 4 – 6 ].
Tingkat TAG yang tinggi dikaitkan dengan gangguan metabolik seperti penyakit kardiovaskular dan diabetes, sering kali dihubungkan dengan obesitas dan metabolisme TAG yang tidak teratur pada manusia [ 7 , 8 ]. Mengingat fungsinya yang penting dalam metabolisme lipid dan pentingnya bagi banyak aktivitas fisiologis, minat terhadap DGAT1 telah meningkat secara signifikan dalam beberapa tahun terakhir. Selain sistem penyimpanan energi yang penting, produksi TAG memungkinkan sel untuk menangani asam lemak bebas berlebih dan menghindari akumulasinya ke tingkat yang berbahaya [ 9 – 13 ]. Oleh karena itu, dengan meningkatkan produksi TAG, DGAT1 memastikan bahwa sel dapat menyimpan asam lemak ini dengan aman dan memanfaatkannya saat diperlukan, menjaga keseimbangan lipid dan mencegah gangguan metabolisme. Selain itu, DGAT1 diperlukan untuk metabolisme hati, terutama yang berkaitan dengan penyakit hati berlemak nonalkohol, yang ditandai dengan penumpukan lemak berlebihan di sel-sel hati.
Bahasa Indonesia: Di luar fungsinya dalam metabolisme lipid, DGAT1 juga terlibat dalam berbagai proses fisiologis dan patologis. Dalam hal penyakit kardiovaskular, akumulasi lipid yang berlebihan, terutama TAG, dapat menyebabkan masalah seperti aterosklerosis dan penyakit peredaran darah lainnya. Ketidakseimbangan aktivitas DGAT1 dapat memperburuk akumulasi lipid dalam pembuluh darah, meningkatkan risiko perkembangan plak dan mengakibatkan peradangan dan kerusakan pada sistem vaskular [ 8 ]. Selain itu, berbagai kanker menunjukkan peningkatan produksi TAG, yang menunjukkan pengaruh potensial pada kelangsungan hidup dan proliferasi sel kanker [ 14 , 15 ]. Berbagai peran DGAT1 ini menunjukkan mengapa ia telah mendapatkan minat yang signifikan dari para peneliti baru-baru ini. Ia bertindak sebagai penghubung penting antara penyimpanan energi, metabolisme lipid, dan pengaturan berbagai proses seluler.
DGAT1 termasuk dalam famili MBOAT (membrane-bound O-acyltransferase), kumpulan enzim beragam yang terdapat pada semua organisme hidup [ 16 – 18 ]. Dalam genom manusia, terdapat 11 enzim MBOAT yang unik, masing-masing dengan spesialisasinya sendiri dalam mengasilasi berbagai lipid atau protein [ 19 – 21 ]. Enzim-enzim ini, termasuk DGAT1, berbagi kerangka struktural yang sama dengan 9–12 domain transmembran (TM) dalam membran organel seperti ER. Enzim MBOAT memiliki rongga atau kantong khusus yang dikenal sebagai ruang reaksi, yang sangat penting untuk pengikatan substrat dan proses enzimatik. Rongga-rongga ini memungkinkan enzim untuk mengakomodasi substrat dengan berbagai bentuk dan ukuran molekul, memastikan spesifisitas dalam proses asilasi.
Teknik mikroskopi kriogenik elektron partikel tunggal (cryo-EM) telah digunakan untuk menguraikan struktur DGAT1 manusia dimerik (Gambar 1 ) [ 22 , 23 ]. Oleoil-CoA diamati di ruang reaksi dalam inti hidrofobik membran. Oleoil-CoA, yang diposisikan di dekat residu HIS415 (residu penting untuk reaksi enzimatik) [ 16-23 ] , menunjukkan konformasi ekor asil melengkung dan menempati bukaan substansial antara TM7 (399–424), TM8 (428 hingga 447), dan TM9 (450–481). Lebih jauh lagi, ada bukaan lateral tambahan pada sisi berlawanan dari protein, berdekatan dengan TM1 (85–111), EL1 (112–130), dan TM5 (274–307), sebagian besar tertanam dalam membran dwi lapis sebagai bagian dari sisi terluar protein pada sisi sitosolik, yang mungkin digunakan untuk masuknya DAG dan keluarnya TAG (Gambar S1 ). Meskipun pengikatan DGAT1-substrat telah dieksplorasi menggunakan teknik eksperimental, sejauh pengetahuan kami, tidak ada studi simulasi untuk menyelidiki interaksi antara DGAT1 dan substrat dan produknya, serta jalur masuk dan keluarnya. Dalam studi ini, kami telah menggunakan simulasi dinamika molekuler (MD) semua atom untuk mengeksplorasi interaksi rumit antara kompleks dimerik DGAT1 dan substratnya (DAG dan asil-CoA) dan produknya (TAG dan CoA), serta jalur masuk dan keluarnya.
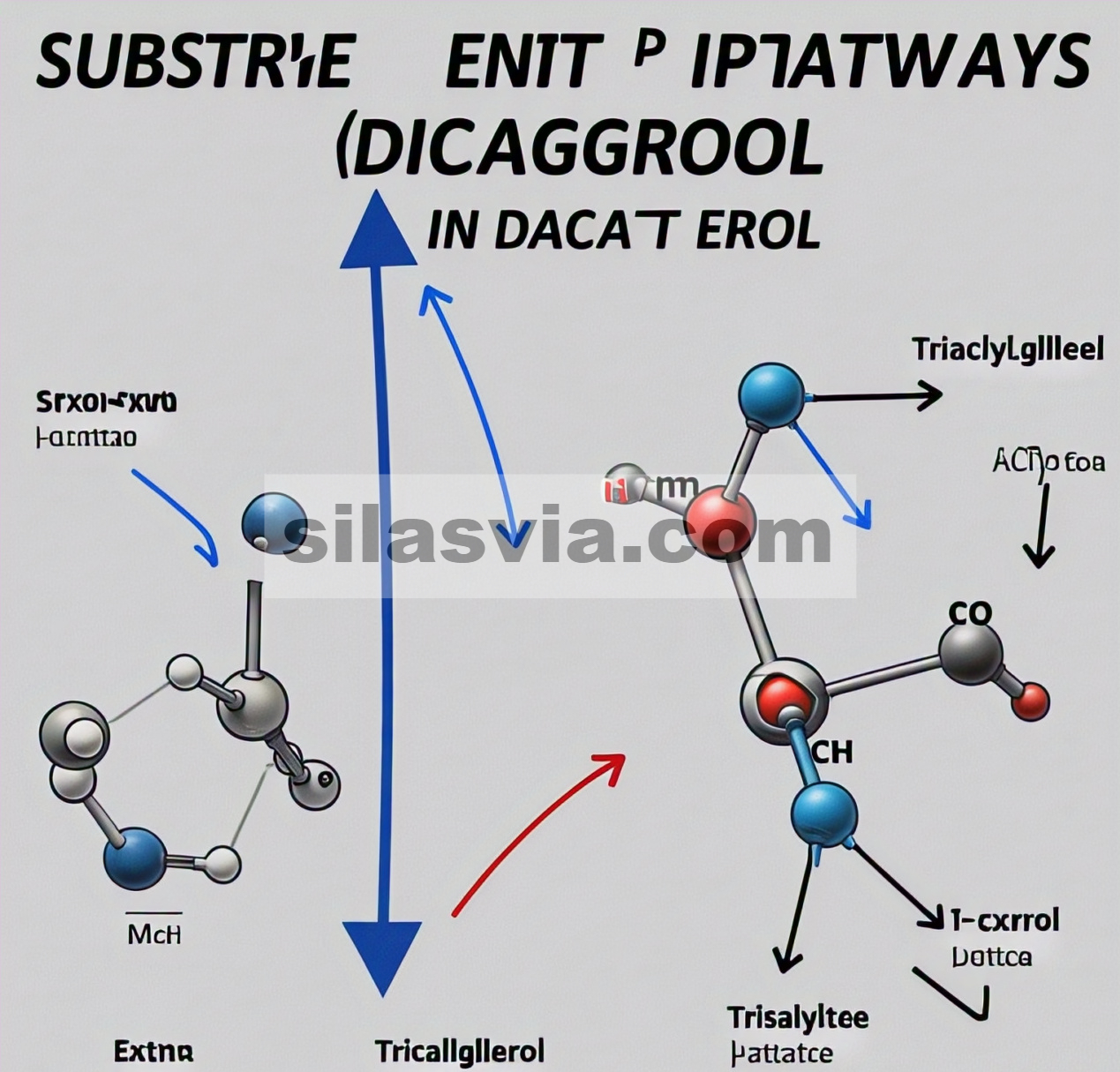
 GAMBAR 1
GAMBAR 1
Buka di penampil gambar
Kekuatan Gambar
Representasi kartun dan struktur kimia DGAT1, DAG, asil-CoA, dan TAG. (A) Topologi DGAT1. Setiap struktur sekunder diberi warna yang berbeda. Perhatikan bahwa sisi sitosolik selalu berada di sisi daun bagian bawah pada semua gambar yang mengandung membran dalam karya ini. (B) Tampilan atas ruang reaksi dari sisi lumen ER dengan ikatan asil-CoA (kepadatan abu-abu). (C) Tampilan samping kompleks dimerik DGAT1. (D, E) Struktur kimia (D) asil-CoA dan (E) DAG dan TAG yang digunakan dalam penelitian ini.
2 Metode
2.1 Detail Sistem Simulasi
Untuk menyelidiki jalur masuk dua substrat (DAG dan acyl-CoA) ke DGAT1, dua set sistem simulasi MD semua atom (Tabel 1 ) disiapkan dengan struktur dimer DGAT1 cryo-EM (PDB ID: 6VP0) [ 22 ]. Pertama, 1,2-dioleoyl-3-phosphatidylcholine (DOPC), 1,2-dioleoyl-3-phosphatidylethanolamine (DOPE), dan 1,2,-dioleoyl-3-phosphatidylserine (DOPS) ditambahkan ke sistem pada rasio DOPC:DOPE:DOPS = 5:3:2 untuk meniru membran ER umum. Selain itu, 10 molekul DAG 1,2-dioleoyl-gliserol didistribusikan secara acak di membran jauh dari DGAT1. Selain itu, kami menyertakan molekul asil-CoA dalam ruang reaksi berdasarkan struktur 6VP0 ( terikat DGAT1 , Gambar 2A ). Untuk sistem kedua ( jauh dari DGAT1 , Gambar 2B ), kami mengeluarkan molekul asil-CoA dalam ruang reaksi dan menempatkan 10 salinan molekul asil-CoA secara acak dalam lembaran sitoplasma jauh dari DGAT1. Semua sistem simulasi dihasilkan menggunakan CHARMM-GUI Membrane Builder [ 24-27 ] dan diseimbangkan dengan mengikuti protokol minimisasi dan penyeimbangan standar Membrane Builder . Sebanyak 150 mM KCl dan air TIP3P [ 28 ] ditambahkan ke wilayah massal. Suhu dipertahankan pada 310,15 K oleh dinamika Langevin, dan tekanan dipertahankan pada 1 bar dengan metode barostat Monte Carlo semi-isotropik dengan frekuensi kopling 5 ps −1 [ 29 , 30 ]. Semua simulasi keseimbangan 5 μs dilakukan menggunakan OpenMM [ 31 , 32 ]. Kemudian, sistem yang diseimbangkan diubah ke dalam format Anton2 untuk memperpanjang waktu simulasi hingga 10 μs [ 33 ]. Medan gaya CHARMM36m untuk protein dan lipid digunakan [ 34-37 ] . Untuk simulasi Anton, kopling tekanan ensemble NPT ditangani menggunakan barostat Martyna–Tobias–Klein dengan kopling suhu Nose–Hoover untuk mempertahankan suhu pada 310,5 K [ 38 ] . Lintasan disimpan berdasarkan langkah waktu 2 fs dengan frekuensi bingkai 240 ps. Metode peralihan gaya batas 10–12 Å [ 39 ] digunakan untuk interaksi van der Waals, dan metode Ewald partikel-mesh [ 40 ] digunakan untuk interaksi elektrostatik jarak jauh. Gambar-gambar tersebut dibuat dengan VMD [ 41 ] dan paket PyMOL.
TABEL 1. Sistem simulasi dengan asil-CoA, DAG, CoA, dan TAG.
 Tiga konformasi awal yang berbeda digunakan, dengan lima sistem replikasi untuk setiap konformasi.
Tiga konformasi awal yang berbeda digunakan, dengan lima sistem replikasi untuk setiap konformasi.
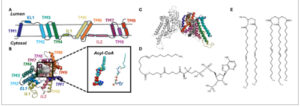
 GAMBAR 2
GAMBAR 2
Buka di penampil gambar
Kekuatan Gambar
Gambaran singkat sistem simulasi awal. (A) DGAT1 terikat dengan asil-CoA yang terletak di ruang reaksi setiap protomer, dan 10 DAG terdistribusi bebas pada membran dwi lapis. (B) DGAT1 menjauh dengan kedua substrat (10 molekul asil-CoA dan 10 molekul DAG) yang terletak jauh dari DGAT1. Protomer A dan B masing-masing diwarnai biru dan merah. DAG diwarnai cyan (ekor) dan merah (kepala gugus), dan asil-CoA diwarnai ungu. Ion dan air dihilangkan demi kejelasan.
Dari simulasi Anton terikat DGAT1 , snapshot terakhir yang berisi susunan dekat antara atom oksigen DAG dan atom sulfur asil-CoA diekstraksi. Melalui minimisasi singkat menggunakan CHARMM [ 35 ], molekul DAG dan asil-CoA diubah menjadi molekul TAG dan CoA. Setelah konversi, simulasi ekuilibrasi 5 μs dilakukan menggunakan OpenMM. Karena tidak ada pengamatan keluarnya produk, tiga snapshot acak dari lintasan OpenMM dipilih, dan lima replikasi dari setiap snapshot digunakan untuk simulasi gaya bias adaptif (ABF) [ 42 ]. Untuk simulasi ABF, modul CHARMM-GUI Enhanced Sampler [ 43 ] digunakan. Sebanyak 100 simulasi ABF ns untuk 15 replikasi dilakukan dengan menggunakan NAMD [ 44 ] dengan ukuran bin 0,4 Å dan 100 sampel penuh. Dua variabel kolektif (CV) didefinisikan berdasarkan jarak antara pusat massa (COM) HIS415 di ruang reaksi dan atom sulfur CoA atau atom oksigen TAG. Nilai 20 Å untuk batas bawah dan dinding bawah serta nilai 90 Å untuk batas atas dan dinding atas digunakan dengan konstanta dinding 10 kkal/(mol·Å 2 ).
3 Hasil dan Pembahasan
3.1 Acyl-CoA Mendekati Ruang Reaksi Katalitik Melalui Pembukaan TM7–TM8 melalui Interaksi Elektrostatik
Fokus awal kami adalah pada investigasi interaksi antara asil-CoA dan DGAT1 dan bagaimana interaksi tersebut memandu masuknya asil-CoA menuju ruang reaksi. Selama simulasi OpenMM 5 μs dari DGAT1 , molekul asil-CoA tertentu berakhir pada jarak yang cukup jauh dari protein, dan yang lainnya bergerak mendekati kompleks protein, baik ke sekitar ruang reaksi atau ke bagian protein yang berbeda. Beberapa molekul asil-CoA mencoba memasuki kantong katalitik dengan berinteraksi dengan TM7 dan TM8. Dalam kasus tersebut, saat asil-CoA mendekati bagian luar ruang reaksi, gugus kepala asil-CoA pertama kali memulai kontak dengan kedua TM (Gambar 3A ). Secara khusus, gugus fosfat dari asil-CoA membentuk interaksi elektrostatik yang kuat dengan residu bermuatan positif, seperti ARG404 dan LYS400 pada TM7 dan ARG441 pada TM8. Selama simulasi Anton yang diperluas, sementara gugus fosfat asil-CoA tetap berada di luar berinteraksi dengan TM7 dan TM8, ekor asil bergerak di antara TM7 dan TM8 dan kemudian ke dalam ruang reaksi, dan akibatnya, atom sulfurnya mempertahankan interaksi dengan HIS415 (Gambar 3B ). Kemudian, gugus kepala asil-CoA bergerak ke dalam ruang reaksi melalui celah antara TM7 dan TM8 (Gambar 3C ). Snapshot akhir setelah simulasi Anton 10 μs menampilkan konformasi asil-CoA yang sebanding dengan oleoil-CoA dalam struktur cryo-EM (Gambar 3D ). Sangat menarik untuk dicatat bahwa tidak ada satu pun molekul DAG yang menunjukkan peristiwa apa pun untuk memasuki ruang reaksi di DGAT1 , yang menunjukkan pentingnya pengikatan donor ekor asil sebelum substrat akseptor (DAG) di DGAT1 dalam studi simulasi kami.
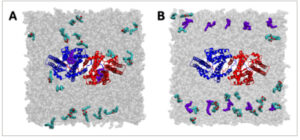
 GAMBAR 3
GAMBAR 3
Buka di penampil gambar
Kekuatan Gambar
Jalur masuk asil-CoA. (A) Kontak awal asil-CoA dengan residu TM7 (berwarna merah)-TM8 (berwarna ungu) (LYS400, ARG404, dan ARG441). (B) Interaksi antara HIS415 dengan sulfur dalam asil-CoA. (C) Tampilan samping perilaku masuk lengkap asil-CoA melalui celah antara TM7 dan TM8. Tampilan atas cuplikan masuk dari sisi sitosol ditunjukkan di samping tampilan samping. (D) Konformasi akhir asil-CoA dari simulasi MD dan struktur cryo-EM.
3.2 DAG Lebih Suka Memasuki DGAT1 Dengan Acyl-CoA Terikat di Ruang Reaksi
Berikutnya, jalur masuk DAG dieksplorasi dengan keberadaan asil-CoA di ruang reaksi seperti dalam struktur cryo-EM. Selama simulasi OpenMM 5 μs dari ikatan DGAT1 , DAG bergerak bebas di dalam membran (yaitu, berubah-ubah). Molekul DAG tertentu menjadi lebih dekat dengan protein, dan banyak contoh upaya DAG untuk memasuki ruang reaksi diamati. Pada 2 μs simulasi Anton yang diperpanjang, satu DAG memasuki ruang melalui terowongan hidrofobik seperti rongga (kami menyebutnya terowongan DAG) yang dibuat oleh TM1-EL1 dan TM5 dan tetap berada hingga akhir 10 μs (Gambar 4A dan S1 ). Terowongan DAG diposisikan di sisi berlawanan dari rute masuk asil-CoA. Dimulai dari sisi sitosol dan tanpa aksi flip-flop (Gambar 4A ), molekul DAG memasuki ruang reaksi dengan orientasi yang menyelaraskan atom-atom oksigen gugus kepala dengan atom sulfur asil-CoA dengan penyelarasan paralel gugus ekor kedua substrat (Gambar 4B ).
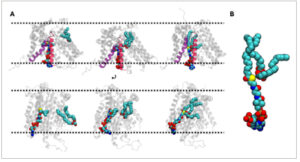 GAMBAR 4
GAMBAR 4
Buka di penampil gambar
Kekuatan Gambar
Jalur masuk DAG. (A) Gambaran DAG yang masuk dengan TM7 (merah) dan TM8 (ungu). Panel bawah memiliki tampilan yang berbeda untuk representasi yang lebih baik dari kedua substrat. Garis putus-putus hitam mewakili posisi kelompok kepala lipid di setiap lembar. (B) Konformasi akhir asil-CoA dan DAG di ruang reaksi.
3.3 Jalur Keluar TAG dan CoA Sesuai dengan Jalur Masuk DAG dan Acyl-CoA
Di ruang reaksi DGTA1, satu ekor asil ditransfer dari asil-CoA ke DAG sebagai bagian dari aktivitas asiltransferase protein. Setelah DGAT1 menyelesaikan aktivitas enzimatiknya, produk (TAG dan CoA) perlu dilepaskan dari ruang reaksi. Untuk mengeksplorasi jalur keluarnya, kami membangun sistem simulasi yang berisi CoA dan TAG ( TAG DGAT1 pada Tabel 1 ) dengan mengubah DAG dan asil-CoA di ruang reaksi menjadi TAG dan CoA dengan minimalisasi singkat karena posisi atom kunci (oksigen dari DAG dan sulfur dari asil-CoA) berada dalam jarak yang cukup dekat (Gambar 5 ).
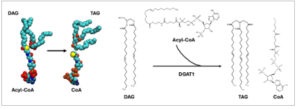 Selama simulasi OpenMM 5 μs awal, baik TAG maupun CoA menunjukkan konformasi yang berbeda di dalam kantong katalitik. Dalam kebanyakan kasus, kedua produk berada dalam jarak dekat dengan interaksi antara CoA-sulfur dan TAG-oksigen. Jika terjadi pemisahan, gugus kepala TAG bergeser menjauh dan bergerak menuju ruang yang sama di terowongan DAG, mirip dengan apa yang digunakan DAG dalam simulasi ikatan DGAT1 . Secara bersamaan, CoA naik menuju celah TM7–TM8 tempat asil-CoA memasuki ruang reaksi dalam simulasi ikatan DGAT1 . Meskipun menunjukkan konformasi yang beragam di dalam ruang reaksi, kedua produk tetap berada di dalam, melakukan upaya terpisah untuk keluar dari kompleks protein. Oleh karena itu, untuk memperoleh wawasan lebih dalam tentang proses keluarnya pascakatalitik, kami memilih untuk menggunakan metode ABF guna meningkatkan pengambilan sampel dengan menerapkan penyesuaian berkelanjutan terhadap energi bebas di sepanjang dua CV yang dipilih (jarak antara COM HIS415 di ruang reaksi dan atom sulfur CoA atau atom oksigen TAG, lihat juga Metode). Sementara ABF umumnya digunakan untuk penilaian energi bebas, fokus kami adalah memahami transisi substrat dalam sistem. Akibatnya, kami memilih untuk tidak melakukan kalkulasi energi bebas dalam simulasi ABF kami, karena hal itu tidak penting bagi penyelidikan kami, yang terutama difokuskan pada analisis perilaku dan transisi substrat.
Selama simulasi OpenMM 5 μs awal, baik TAG maupun CoA menunjukkan konformasi yang berbeda di dalam kantong katalitik. Dalam kebanyakan kasus, kedua produk berada dalam jarak dekat dengan interaksi antara CoA-sulfur dan TAG-oksigen. Jika terjadi pemisahan, gugus kepala TAG bergeser menjauh dan bergerak menuju ruang yang sama di terowongan DAG, mirip dengan apa yang digunakan DAG dalam simulasi ikatan DGAT1 . Secara bersamaan, CoA naik menuju celah TM7–TM8 tempat asil-CoA memasuki ruang reaksi dalam simulasi ikatan DGAT1 . Meskipun menunjukkan konformasi yang beragam di dalam ruang reaksi, kedua produk tetap berada di dalam, melakukan upaya terpisah untuk keluar dari kompleks protein. Oleh karena itu, untuk memperoleh wawasan lebih dalam tentang proses keluarnya pascakatalitik, kami memilih untuk menggunakan metode ABF guna meningkatkan pengambilan sampel dengan menerapkan penyesuaian berkelanjutan terhadap energi bebas di sepanjang dua CV yang dipilih (jarak antara COM HIS415 di ruang reaksi dan atom sulfur CoA atau atom oksigen TAG, lihat juga Metode). Sementara ABF umumnya digunakan untuk penilaian energi bebas, fokus kami adalah memahami transisi substrat dalam sistem. Akibatnya, kami memilih untuk tidak melakukan kalkulasi energi bebas dalam simulasi ABF kami, karena hal itu tidak penting bagi penyelidikan kami, yang terutama difokuskan pada analisis perilaku dan transisi substrat.
Awalnya, CoA terutama berada di dekat celah antara TM7 dan TM8, sementara gugus kepala CoA mempertahankan interaksi dengan residu polar dan bermuatan pada TM7 (THR371, TYR390, LYS400, dan ARG404) dan TM8 (ALA441, ARG446, dan THR371) (Gambar S2 ). Setelah keluar, CoA bergerak menuju wilayah pelarut massal daripada lapisan ganda membran. Setelah itu, kami mengamati bagaimana TAG keluar dari ruang reaksi menggunakan terowongan yang sama yang digunakan untuk masuknya DAG (Gambar S1 ). Saat TAG meninggalkan kompleks protein, ia dilepaskan ke membran lapisan ganda bersama fosfolipid lain dan DAG (Gambar S3 ). Selama jalur keluarnya, gugus kepala berinteraksi sebentar dengan GLN292 pada TM5, yang diposisikan dekat dengan TM1, dan TYR477 pada TM9, yang terletak tepat di belakang TM5 (Gambar S3 ). Dalam contoh yang berbeda, TAG keluar dengan bergerak langsung ke atas di atas lapisan ganda membran dan ke dalam air massal, daripada berintegrasi ke dalam lapisan ganda dengan lipid lainnya. Perilaku ini berpotensi menjadi artefak simulasi ABF atau keterbatasan metode pengambilan sampel yang ditingkatkan, yang mungkin tidak selalu sepenuhnya menangkap lanskap energi bebas yang sebenarnya. Namun, simulasi lebih lanjut tanpa ABF menunjukkan integrasi TAG ke dalam lapisan ganda. Untuk memvalidasi keakuratan hasil ABF kami, investigasi tambahan ke dalam jalur keluar TAG diperlukan dengan interpretasi yang cermat. Secara keseluruhan, simulasi ABF secara efektif menunjukkan jalur unik bagi kedua produk untuk keluar dari kompleks dimerik DGAT1. Setelah proses katalitik, akumulasi TAG di dalam membran diketahui terjadi, yang mengakibatkan terciptanya tetesan lipid [ 45 , 46 ].
4 Kesimpulan
Dengan menggunakan simulasi MD konvensional dan metode pengambilan sampel yang ditingkatkan ABF, kami telah mengidentifikasi jalur dua substrat (DAG dan asil-CoA) dan produk (TAG dan CoA) di DGAT1. Selama waktu simulasi kami, setiap substrat dan produk menunjukkan pilihan yang khas untuk jalur masuk dan keluarnya. Asil-CoA mengakses ruang reaksi melalui bukaan TM7–TM8 saat mendekati protein dari luar membran dwilapis pada sisi sitosolik. Sebaliknya, DAG mencoba mencapai ruang reaksi melalui bukaan berbeda yang terletak di sisi berlawanan dari protein (TM1-EL1-TM5) di sisi sitosolik. Selama proses masuk, satu DAG memasuki ruang reaksi dan melakukan kontak dengan asil-CoA yang terikat. Dengan tidak adanya asil-CoA, tidak ada DAG yang berhasil memasuki protein (selama waktu simulasi kami), yang dapat menunjukkan pentingnya urutan pengikatan substrat. Walaupun pengikatan asil-CoA tidak mengakibatkan perubahan konformasi apa pun pada protein, hal itu mungkin berdampak pada perekrutan DAG.
Dalam penelitian sebelumnya [ 22 , 23 ], beberapa residu kunci dimutasi secara eksperimental untuk menguji keterlibatannya dalam aktivitas enzimatik DGAT1. Mutasi titik pada residu ini (THR371, TYR390, LYS400, dan ARG404) yang terletak di dekat ruang reaksi mengakibatkan penurunan aktivitas enzimatik sedang (30%–70%). Selain itu, mutasi yang terjadi pada residu yang lebih dalam di dalam ruang reaksi (TRP377, ASN378, HIS382, dan SER411) menyebabkan penurunan aktivitas yang lebih signifikan, melebihi penurunan 80%. Ini mungkin menunjukkan bahwa substrat asil-CoA perlu distabilkan selama proses katalitik oleh residu yang terletak di dalam ruang reaksi. Mutasi residu di situs aktif, HIS415 dan GLU416—keduanya sangat terkonservasi dalam keluarga MBOAT—mengakibatkan gangguan aktivitas yang hampir lengkap. Hasil serupa juga diamati dalam penelitian lain. Mutasi residu yang terkonservasi dengan baik, HIS415, menjadi alanin sepenuhnya menghapus aktivitas enzimatik, yang menyoroti perannya dalam proses transfer asil. Mutasi ASN378, GLN437, dan GLN465 menjadi alanin juga secara signifikan mengurangi aktivitas DGAT1 sebesar 50%–75%, yang menunjukkan signifikansi fungsional residu dalam ruang reaksi. Mutasi MET324 juga menunjukkan aktivitas yang berkurang, yang dikenal sebagai residu yang membentuk ikatan hidrogen dengan His415 tanpa adanya substrat. Lebih jauh, mutagenesis pada VAL381, CYS385, VAL407, dan SER411 menunjukkan pentingnya kontribusi TM7–TM8 karena aktivitas DGAT1 menurun dengan substitusi residu ini dengan asam amino hidrofobik yang lebih besar.
Jelas, semua studi mutasi sebelumnya didasarkan pada struktur yang ada dan sebagian besar difokuskan pada residu di sekitar ruang reaksi. Kami percaya bahwa simulasi kami menawarkan peluang unik untuk mempelajari residu yang terlibat dalam jalur masuk substrat dan keluarnya produk. ARG404 dan LYS400 pada TM7 dan ARG441 pada TM8 membentuk interaksi elektrostatik yang kuat dengan asil-CoA dan tampaknya menariknya ke celah TM7–TM8 dan kemudian ke ruang reaksi (Gambar 3 ). Interaksi ini juga terlibat dalam keluarnya CoA (Gambar S2 ). Selama masuknya DAG melalui terowongan TM1-EL1-TM5, DAG tampaknya berinteraksi dengan berbagai residu: TYR111, VAL115, dan PRO117 pada TM1-EL1, MET285, ILE296, dan TRP340 pada TM5, serta ASN141 pada TM2. Selama jalur keluarnya, TAG juga berinteraksi dengan residu serupa, terutama TYR111, LEU114, dan VAL115 pada TM1-EL1-TM2 (Gambar S3 ). Akan menarik untuk melihat studi mutasi pada residu ini dan dampaknya pada fungsi DGAT1.
Karena studi tikus knockout genetik DGAT1 menunjukkan tingkat sintesis TAG yang sangat berkurang di berbagai jaringan [ 7 , 47 , 48 ], banyak studi klinis dilakukan, sebagian besar berfokus pada pengembangan inhibitor molekul kecil farmakologis [ 49 – 53 ]. Inhibitor ini dirancang untuk mengikat ke situs aktif DGAT1, sehingga memblokir aktivitas enzimatiknya dan mengurangi sintesis TAG. Meskipun ada kemajuan, proses molekuler spesifik yang mengarah pada pemblokiran produksi DGAT1 dan TAG oleh zat-zat ini tidak sepenuhnya dipahami. Dalam studi praklinis, beberapa inhibitor DGAT1, seperti A922500 [ 54 ], PF-04620110 [ 55 , 56 ], dan T863 [ 57 ], telah menunjukkan potensi dalam mengurangi kadar TAG, yang menunjukkan kemungkinan penggunaannya dalam mengelola gangguan terkait lipid. Misalnya, inhibitor T863 mengikat ke situs pengikatan asam lemak-CoA dari DGAT1, mencegah masuknya asam lemak dan mengurangi produksi TAG [ 23 ]. Dalam model tikus diabetes tipe 2, PF-04620110 Pfizer telah terbukti menurunkan kadar TAG darah dan peradangan dengan secara khusus menghambat DGAT1. Namun, inhibitor ini dapat memiliki efek samping yang signifikan. AZD7687 AstraZeneca [ 53 ] menyebabkan mual, muntah, dan diare selama uji klinis, sementara PF-04620110 menyebabkan diare parah dan bahkan kematian dalam pengujian hewan. Selain itu, senyawa seperti Pradigastat [ 58 ] dan A922500 telah dikaitkan dengan masalah kulit pada tikus, termasuk rambut rontok dan atrofi kelenjar sebasea, yang menunjukkan kemungkinan efek samping jangka panjang. Dalam konteks ini, penelitian kami merupakan langkah maju yang besar di area ini dengan menyajikan visualisasi komprehensif dari jalur yang diambil oleh substrat dan produk dalam kompleks protein DGAT1. Visualisasi ini menawarkan perspektif penting yang dapat membantu mengungkap detail proses yang bertanggung jawab atas penghambatan yang diamati, sehingga membuka pintu bagi pendekatan pengobatan yang terfokus pada gangguan metabolisme lipid. Dengan menggunakan simulasi MD yang ekstensif, kami telah dengan cermat menentukan dan menggambarkan titik masuk yang berbeda dan residu yang berinteraksi untuk molekul asil-CoA dan DAG. Eksplorasi mendalam tentang interaksi substrat dan perubahan struktural ini tidak hanya meningkatkan pemahaman kita tentang arsitektur rumit DGAT1, tetapi juga memberikan pemahaman yang berharga tentang keluarga protein MBOAT yang lebih luas. Lebih jauh, mereka meletakkan dasar bagi kemajuan yang akan datang yang dapat mengubah cara kita menyelidiki dan mengendalikan fungsi anggota keluarga MBOAT.